이산화탄소 흡수제 소다 라임(Soda Lime)
재호흡기 다이버는 누구나 필수 소모품인 소다 라임을 사용합니다. 저 역시 많은 시간 소다 라임을 사용하였습니다. 어느 날 문득 “소다 라임이 어떻게 이산화탄소를 걸러주는 걸까?”라는 의문을 갖게 되었습니다. 그래서 찾아봤고 정리해 놓은 자료를 포스팅합니다.
=================================================
이산화탄소 흡수제
○ 목차
1. 이산화탄소 흡수제란?
2. 이산화탄소 흡수제의 역할
3. 이산화탄소 흡수제의 종류
4. 이산화탄소 흡수제 구성 성분
5. 화학식
6. 수산화칼슘(Ca(OH)2)
7. 탄산 칼슘(CaCO3)
8. 수산화나트륨(NaOH)
9. 탄산수소나트륨(NaHCO3)
10. 소다라임의 항공 수송
11. 관련 영상
1. 이산화탄소 흡수제란?
• 수산화 칼슘과 수산화 나트륨으로 구성된 이산화탄소를 흡수하는 화학 혼합물
• 재호흡기 다이버가 재호흡을 하기 위해 꼭 필요한 화학물질
• 수분을 만나면 화학 반응을 일으켜 열을 발생 시키는 물질
2. 이산화탄소 흡수제의 역할
• 이산화탄소의 제거
3. 이산화탄소 흡수제의 종류
• 제조사별
– Intersorb
– Sofnolime
• 제품별
– Intersorb 812
– Sofnolime 797

출처 : https://www.apdiving.com/shop/media/catalog/product/cache/1/image/9df78eab33525d08d6e5fb8d27136e95/s/o/sofnolime-rb31-rebreather-consumables-ap-diving.jpg

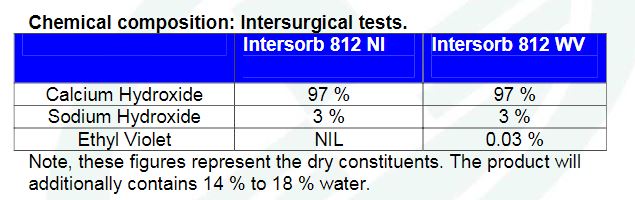
4. 이산화탄소 흡수제 구성 성분
화학적 구성(Intersorb 812)
| 분 자 명 | 비 율 |
|---|---|
| Sodium Hydroxide(수산화 나트륨) | 3% |
| Calcium Hydroxide(수산화 칼슘) | 97% |
출처 : Technical Data – Intersorb® (http://www.divelime.com/dldownloads/Intersorb812_DiveGrade_TDS_4411.pdf)
5. 화학식
Sofnolime®은 발열, 물 촉진, 염기 촉매 화학 반응을 통해 가스 흐름에서 이산화탄소 (및 기타 산성 오염 물질)를 제거합니다. Sofnolime®에는 반응을 돕는 세 심하게 조절 된 수준의 물이 포함되어 있습니다. 물은 또한 부산물로 형성됩니다.
반응.
반응은 3 단계로 진행됩니다.
CO2 (gas) + H2O = CO2 (In solution)
이산화탄소(기체) 물(수분)
(ii) 중탄산염 형성
CO2(aqua) + NaOH = NaHCO3
이산화탄소(액화) 수산화나트륨 탄산수소나트륨
(iii) NaOH 촉매의 분해 / 재생
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
탄산수소나트륨 수산화칼슘 탄산칼슘 수산화나트륨 물
전반적인 균형 방정식은 다음과 같습니다 :
H2O / NaOH
CO2 (g) + Ca(OH)2(s) = CaCO3(s) + H2O(l) + 열
이산화탄소(기체) 수산화칼슘(고체) 탄산 칼슘(고체) 물(액체)
출처 : http://www.molecularproducts.com/wp-content/uploads/2017/01/Sofnolime-1025-NI-UK-DS-V3.pdf
Sofnolime-1025-NI-UK-DS-V3
————————————————————————————————————–
전반적인 반응은 다음과 같습니다 :
CO2 + Ca(OH)2 → CaCO3 + H2O + heat (물이있는 곳에서)
수산화칼슘과 반응하는 CO2 (44g) 1 몰은 물 1 몰 (18g)을 생성합니다.
이 반응은 강염기 촉매, 수성 반응으로 간주 할 수 있습니다.
이산화탄소와 소다 석회의 반응 메커니즘은 세 가지 기본 단계로 분해 될 수 있습니다. :
1) CO2 (g) → CO2 (aq)
(CO2는 물에 용해 – slow and rate-determining)
2) CO2 (aq) + NaOH → NaHCO3 (높은 pH에서 중탄산염 형성)
3) NaHCO3 + Ca(OH)2 → CaCO3 + H2O + NaOH ((2 단계로 재활용 된 NaOH) – 여기서부터 촉매)
이 일련의 반응은 시스템에서 수산화 나트륨이 수행하는 촉매 역할과 소다 석회가 수산화칼슘 단독보다 화학적 반응성이 더 빠른 이유를 설명합니다. 그것은 훨씬 더 빨리 반응하므로 재호흡 회로에서 CO2를 더 빨리 제거하는 데 기여합니다. 물의 형성과 호흡으로 인한 수분은 반응의 용매 역할도 합니다. 수상에서의 반응은 일반적으로 건조 기체와 건조 고체 사이의 반응보다 빠릅니다.
출처 : https://en.wikipedia.org/wiki/Soda_lime
6. 수산화칼슘(Ca(OH)2)

요약
• 소석회
• 무색 결정 또는 백색 가루
• 석회석이 주원료
• 산화칼슘(석회 또는 생석회라고도 함)을 물에 소화시켜 만듦
• 무기 염기성의 화학적 화합물
용도
• 수산화칼슘은 가스 제조 시 암모니아 회수에 사용되며 저급 고무 화합물의 촉진제로 사용됨
• 몰타르, 회반죽, 시멘트, 칼슘염 및 가성소다의 제조에 사용되며 산성토양의 토양 처리, 수처리에서 경수연화제, 노반재를 위한 지반안정 처리, 살충제 등에도 사용됨
독성자료
• 입, 인후, 식도 및 위에 작열감 또는 화상을 유발할 수 있음
• 증상은 위경련, 구역증, 구토, 설사, 쇠약, 어지럼증, 실신, 졸음 등이고 혼수상태에 이를 수도 있음
• 섭취후 수주 혹은 수 개월 혹은 수 년 후에 식도협착이 발생하여 삼키는 것이 힘들어질 수 있음
• 액틴-미오신 조직을 방해하며 혈액 pH를 상승시킬 수 있음
• 혈액 pH의 상승은 내부 기관에 유해함
• 반복적으로 또는 장기간 노출될 경우 피부염을 일으킬 수 있음
• 눈의 접촉시 통증, 과도한 눈물, 결막 부종, 출혈, 각막 부종, 혼탁화를 동반한 중증 자극 또는 화상을 유발할 수 있음
주의사항
• 열, 화염, 불꽃 및 기타 발화원을 멀리해야 함
• 막힌 공간에서는 위험한 가스가 축적될 수 있음
• 가연성 물질과 접촉되면 발화하거나 폭발할 수 있음
응급처치
• 유해반응이 발생하면 오염되지 않은 구역으로 이동
• 숨을 쉬지 않으면 인공 호흡을 함
• 호흡하기 어려울 경우 유자격자가 산소를 공급해야 하고 즉시 의사의 진료를 받아야 함
• 오염된 옷과 신발을 벗고 적어도 15분 동안 비누와 물로 피부를 씻어 내고 즉시 의사의 진료를 받아야 함
• 다시 사용하기 전에 오염된 옷과 신발을 철저히 세탁 및 건조
• 오염된 신발은 폐기
• 최소 15분간 많은 양의 물로 즉시 눈을 씻고 나서 즉시 의사의 진료를 받아야 함
• 삼켰을 경우 많은 양의 물을 마시되 구토는 하지 않고 즉시 의사의 진료를 받아야 함
• 위 세척이나 구토는 하지 않음
출처 : 식품의약품안전처 식품의약품안전평가원 독성정보제공시스템
(http://www.nifds.go.kr/toxinfo/SearchUtil_getDetailChemTcd.action?hddnToxicCode=T1000000094)
(https://www.nifds.go.kr/toxinfo/tcd/info/tcdDetailPop.do?toxicCode=T1619336198289)
pdf 파일 : Report_Calcium hydroxide_1305-62-0
7. 탄산 칼슘(CaCO3)
• 석회석, 대리석, 방해석, 선석(霰石), 백악, 빙주석(氷洲石), 조개껍질, 달걀 껍질, 산호의 주성분
• 탄산이온과 칼슘이온이 만나 생성되는 흰색 물질로서 물에 잘 녹지 않아 수용액 상에서 침전
• 석회암 동굴의 종유석이나 석순, 석주 등을 이루는 물질이며, 지구상에 존재하는 대부분의 이산화 탄소(CO2)는 탄산 칼슘의 형태로 존재
출처 : 다음 백과(http://100.daum.net/encyclopedia/view/v060mc630a5)
8. 수산화나트륨(NaOH)
요약
• 수산화나트륨(NaOH)은 물에 녹아 강염기성 수용액을 만듦
• 제지, 방직, 식음료, 비누 등의 산업에서 널리 사용됨
• 화학 실험에서 가장 널리 사용되는 염기
• 순수한 수산화나트륨은 흰색 고체
• 대기 중에서 수증기와 이산화탄소를 흡수
• 온도에 무관하게 물에 잘 녹음
• 수산화칼륨은 잘 녹지 않는 에탄올과 메탄올에도 수산화나트륨은 녹음
• 에테르나 다른 무극성 용매에는 녹일 수 없음
• 수산화나트륨 수용액은 섬유와 종이에 노란색 얼룩을 남김
용도
• 대표적인 강염기, 바이오디젤 생산, 마약 제조 등에 이용.
독성자료
• 피부 접촉 시
– 통증이 없는 발적, 피부 화상, 백색 건조가 발생하고 눈에 접촉 시 결막 각막 상태의 붕괴, 딱지
형성, 각막 혼탁이 올 수 있음.
• 섭취 시
– 인두부의 부식, 식도의 통증, 구토, 혈변이 발생할 수 있음.
주의사항
• 삼키면 유해, 호흡기도 화상, 피부 화상, 눈 화상, 점막 화상을 일으킬 수 있음
• 조해성이 있으므로 공기와의 접촉을 차단하여 보관해야 함.
응급처치
• 흡입
– 부작용이 발생하면, 오염되지 않은 지역으로 이동시킬 것. 호흡하지 않을 경우 인공호흡을 할
– 호흡이 곤란하면, 자격증이 있는 요원에 의해 산소가 관리 되어져야 하고 즉시 의사의 치료를 받을 것 • 피부 접촉
– 오염된 의복 및 신발을 벗고, 즉시 적어도 15 분 동안 비누와 물로 씻고 즉시 의사의 치료를 받을 것
– 오염된 의복 및 신발은 재사용 전에 철저히 건조시키고 세탁할 것
– 오염된 신발을 파기할 것
• 눈 접촉
– 많은 양의 물을 사용하여 적어도 15 분 동안 눈을 즉시 세척하고 곧바로 의사의 치료를 받도록 할 것
• 섭취
– 만약 삼켰다면, 많은 양의 물을 마시도록 하고, 구토를 유도하지 않도록 할 것. 즉시 의사의 치료를 받
을 것.
• 의사에 대한 정보
– 흡입의 경우에는 산소의 공급을 고려하고 위 세척 또는 구토를 피할 것.
출처 : 식품의약품안전처 식품의약품안전평가원 독성정보제공시스템
(http://www.nifds.go.kr/toxinfo/SearchUtil_getDetailChemTcd.action?hddnToxicCode=T1000000395)
(https://www.nifds.go.kr/toxinfo/tcd/info/tcdDetailPop.do?toxicCode=T159326450589)
pdf 파일 : Report_Sodium hydroxide_1310-73-2
9. 탄산수소나트륨(NaHCO3)

▲ 출처 : https://ko.wikipedia.org/wiki/%ED%83%84%EC%82%B0%EC%88%98%EC%86%8C_%EB%82%98%ED%8A%B8%EB%A5%A8
• 베이킹 소다, 중탄산 나트륨, 중탄산 소다, 중조(重曹) 따위로 불림.
• 상온에서는 백색의 분말상태로, 약간 쓰고 짠맛이 남
• 그리고 과량이 있으면 피부를 부식시킴
• 의약품으로서는 위산과다에 대한 제산제로 쓰임
• 커피와 같은 식용품 및 미용제에도 쓰임
• 백색의 단사정계 결정으로 가열하면 이산화탄소와 물을 발생하고, 탄산나트륨 무수물로 변하는 성질을 지녔음
출처 : https://ko.wikipedia.org/wiki/%ED%83%84%EC%82%B0_%EC%88%98%EC%86%8C_%EB%82%98%ED%8A%B8%EB%A5%A8
10. 소다라임의 항공 수송
• 소다라임은 수화물 검색 통과시 문제됨.
• 소다라임을 가지고 해외 여행시 아래 PDF 파일을 출력해서 가져가면, 공항 보안검색에서 문제가 될 때 도움이 됨.
• 반드시 스티커가 있는 박스에 소다라임을 가져 가야 함. 스티커가 없을 경우 항공사에서는 MSDS(Material Safety Data Sheet)와 일치하는지 확인이 안되기 때문에 운송 거부를 함.
• https://www.premchemltd.com/wp-content/uploads/Intersorb-812-Dive-Grade-TDS-4-April-2011.pdf
• https://www.premchemltd.com/products/soda-lime/intersorb
• http://www.divelime.com/dl_downloads.html
• http://www.divelime.com/dldownloads/MSDS_Intersorb_Nonindicating_diving_grade.pdf
• http://www.divelime.com/dldownloads/Statement_for_NATO_1411_and_EN14143.pdf
• http://www.divelime.com/dldownloads/Intersorb812_DiveGrade_TDS_4411.pdf
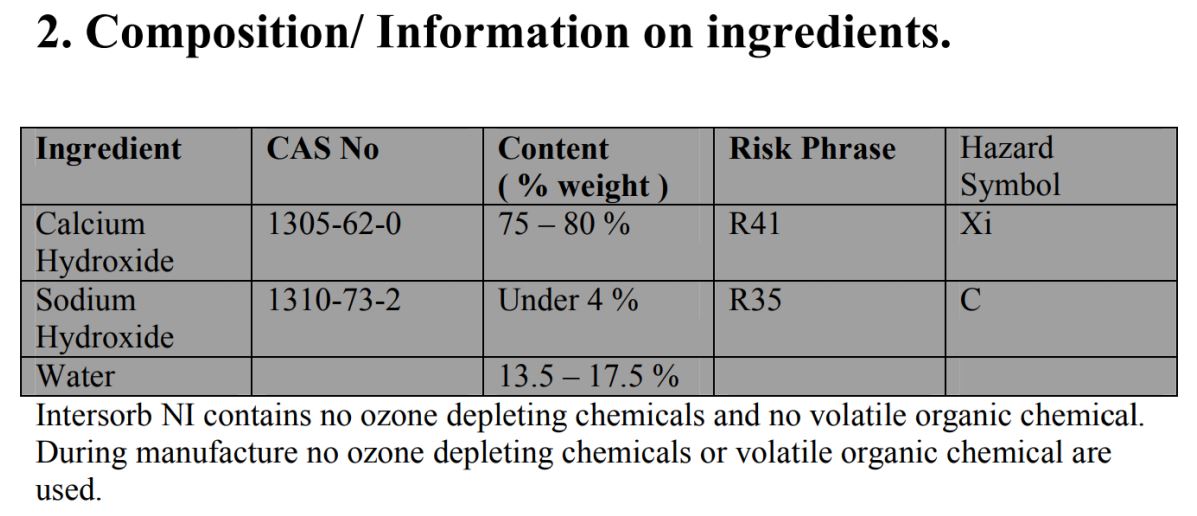
• 스쿠버용 소디움이 Hydroxide 4% 미만이라 수화물 운송 가능.
▲ 출처 : http://www.divelime.com/dldownloads/MSDS_Intersorb_Nonindicating_diving_grade.pdf
▲ 출처 : https://www.premchemltd.com/wp-content/uploads/Intersorb-812-Dive-Grade-TDS-4-April-2011.pdf
11. 관련 영상
소다 라임은 수산화칼슘(Ca(OH)2)과 수산화나트륨(NaOH)으로 구성된 이산화탄소를 흡수하는 화학 혼합물입니다. 수산화칼슘과 수산화나트륨 모두 이산화탄소를 흡수하는 성질을 가지고 있습니다.
수산화칼슘(Ca(OH)2)은 “소석회”라고 불리는 백색 가루이고 석회석의 주원료입니다. 또한 pH는 12.35의 강염기입니다. 가스 제조시 암모니아 회수를 위해 주로 사용되고, 염기성이기에 산성화된 토양의 중성 작업에 사용이 되기도 합니다. 이것은 사용한 소다 라임을 처리할 때 밭이나 나무 주변에 뿌려도 된다는 얘깁니다. 만약 섭취한 경우 많은 양의 물을 마시고 구토는 하지 않는 게 좋습니다. 구토를 하는 과정에서 식도에 화상을 입을 수 있기 때문입니다.
수산화칼슘(Ca(OH)2)이 이산화탄소를 만나면 반응을 하는데 그 결과로 탄산칼슘(CaCO3)과 물이 생기고 열도 발생합니다. 재호흡기 다이빙이 끝나고 유닛을 열면 캐니스터에 물이나 수증기가 있고, 유닛 내부가 따뜻한 이유입니다. 또한 이때 발생하는 탄산칼슘(CaCO3)은 캐니스터 내부에 남아 있는 하얀색 이물질입니다. 탄산칼슘은 물에 녹지 않기에 침전이 되어 생기는 겁니다.
수산화나트륨(NaOH)은 pH13의 강염기입니다. 대기 중에서 수증기와 이산화탄소를 흡수합니다. 역시 강염기이기에 산성화된 토양에 중화제로 사용됩니다. 섭취시는 수산화칼슘과 동일한 처치를 하면 됩니다.
수산화나트륨은 이산화탄소와 만나면 반응을 해서 탄산수소나트륨(NaHCO3)이 됩니다. 일명 “베이킹 소다”라고 불립니다. 쓰고 짠맛이 나며 과량은 피부를 부식시키기도 합니다.
재호흡기를 사용하다 여러 가지 이유로 유닛이 침수가 되는 경우가 있는데 이때 Caustic Cocktail이 발생합니다. 이걸 루프로 통해 섭취하는 경우 강렬한 맛을 느끼게 됩니다. 이것은 소다 라임에 사용된 두 화학물질이 강염기이기 때문입니다.
정리를 하자면,
소다 라임은 이산화탄소를 흡수하는 성질을 가진 수산화칼슘과 수산화나트륨의 혼합물입니다. 이산화탄소와 반응을 해서 하얀색 침전물인 탄산칼슘과 수분, 열을 발생시킵니다. 또한 베이킹 파우더인 탄산수소나트륨이 만들어 집니다. Caustic Cocktail이 발생해서 섭취한 경우 토하지 말고 많은 양의 물을 마시는 게 좋습니다.
소다 라임 = 수산화칼슘(Ca(OH)2) + 수산화나트륨(NaOH)
 첨부의 영상에서 보면 알겠지만 소다 라임이 물에 젖는다고 색깔이 변하거나 하지는 않습니다. 영상으로는 느낄 수 없지만 실제 물에 젖은 소다 라임을 만져보면 매우 미끌미끌 합니다.
첨부의 영상에서 보면 알겠지만 소다 라임이 물에 젖는다고 색깔이 변하거나 하지는 않습니다. 영상으로는 느낄 수 없지만 실제 물에 젖은 소다 라임을 만져보면 매우 미끌미끌 합니다.
※ 제가 전문가가 아니기에 잘못된 정보가 내용에 포함된 경우, 알려 주시면 바로 수정하도록 하겠습니다.
Intersorb-812-Dive-Grade-TDS-4-April-2011


수산화칼슘과 수산화나트륨에 대한 내용은 “식품의약품안전처 식품의약품안전평가원 독성정보제공시스템”에서 발췌되었습니다. 지금은 해당 링크의 주소가 아래로 바뀌었고 내용도 수정되었으니 아래 링크를 참고하시기 바랍니다.
수산화칼슘(Ca(OH)2)
https://www.nifds.go.kr/toxinfo/tcd/info/tcdDetailPop.do?toxicCode=T1619336198289
수산화나트륨(NAOH)
https://www.nifds.go.kr/toxinfo/tcd/info/tcdDetailPop.do?toxicCode=T1593264505893